徐伟文
[摘要] 体外诊断试剂是疾病有效诊治的重要辅助手段。依据《体外诊断试剂注册管理办法》进行该类产品的注册申报,是我国食品药品监督管理局对体外诊断试剂市场准入的要求。本文对体外诊断试剂实验室评价的指标设立及其意义进 行整理阐述,以利于研发设计及验证。
[关键词] 体外诊断试剂;注册;实验室性能评估
疾病的治疗,诊断是第一步,而体外诊断试剂是重要的辅助手段。随着新技术的发展和新疾病靶标的发现,开发新型的体外诊断试剂生生不息。但一个新开发的试剂能否真正面市,除了建立反应模式和体系并进行优化外,合理的性能分析与评估,是必经的程序,也是质量保障的基础。自从我们开始涉及体外诊断试剂的研制开发,就结合临床流行病学中诊断试
剂评价的有关内容以及国家食品药品监督管理局对体外诊断试剂注册审评的要求,对研发的体外诊断试剂试验室评价时的一些实验设计提出一些方案。大部分内容在接下来的应用中得到了肯定,但部分还是存在不清晰或不合理现象。为更好地执行新的《体外诊断试剂注册管理办法》,同时也为了进一步提高研制人员对相关技术指标的科学涵义及其评价设计的认识,促进注册报批质量的提高,特整理相关资料,希望对我们的工作有所帮助。1 定量标记免疫分析方法分析性能评估的主要指标
1.1 灵敏度
1.1.1 分析灵敏度:试剂盒的灵敏度即最低检出量是指在统计学意义上能与零剂量区别的量。一般用95%可信限计算:重复测定零剂量点(n≥10),计算反应量的均值(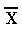 )和标准差(SD),以 )和标准差(SD),以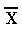 +2SD(夹心法试剂盒)或均值 +2SD(夹心法试剂盒)或均值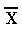 -2SD(竞争抑制法试剂盒)的反应量计算出相应的浓度,即为该试剂盒的分析灵敏度,这是我们注册资料所需提供的内容。 -2SD(竞争抑制法试剂盒)的反应量计算出相应的浓度,即为该试剂盒的分析灵敏度,这是我们注册资料所需提供的内容。
1.1.2 功能灵敏度:将低值样本倍比稀释后重复测定(n≥10),计算反应量的变异系数(CV%),CV%大于20%时所对应的剂量点,即为该试剂盒的功能灵敏度。
1.2 特异性
诚如我们所认识到的,标记免疫分析是特定抗体对特定抗原的特异识别。不同来源的抗体与结构类似物结合从而产生交叉反应是客观存在的,因此特异性检验是正确认识该试剂盒对结构类似物抗干扰能力的指标。特异性检验通常有两种标定方法:
1.2.1 交叉反应率:一定浓度的结构类似物在本试剂盒上的测定结果(物质的量)与该类似物的量的比值的百分率。如:1 000 pmol/L 的结构类似物,在某试剂盒上测定结果是5 pmol/L,其交叉反应率=5 pmol/L/ 1 000 pmol/L * 100%=0.5%。
1.2.2 实际测量值:对于不能用物质的量表示的被测物,如糖蛋白激素FSH、LH、TSH和HCG,这4 种激素具有相同的α亚单位,仅仅是α亚单位上部分氨基酸不同,实际操作中很容易产生交叉反应,而这4 种激素又分别有各自的同形异构物,其量的表达方法还不能用物质的量(mol/L,ng/mL)表示,而只能借助于生物测定的活性单位(IU/L,mIU/L)表示,而每一种激素的活性单位(IU)又有完全不同的生物学意义,相互之间没有任何关联,即并且每一种激素定义的单位意义完全不同,不同来源相同质量的某一种激素的活性单位也不同,它们之间的交叉反应绝对不能用交叉反应率表示,因此往往选择实测值表示。
1.2.3 选择交叉反应对照物:当交叉反应的测量结果高于我们期待的结果时,可以从两个方面分析:首先,该试剂盒抗体确实与这一交叉反应因子存在交叉反应,如FSH 在结构上与另外3 种激素仅仅是α亚单位上个别氨基酸的不同,其特征抗体与其它位点有一定程度的结合的可能性是存在的,这种非特异结合被限制在一定范围内是可以接受的。在另一方面,如果选择的交叉反应对照物中含有少量的被测物,如:欲考察FSH试剂盒对LH的交叉反应,选择的LH抗原中含有少量的FSH,高浓度的这种抗原在FSH试剂盒中的测量结果很可能高于所期待的结果,应充分认识到这种结果并不是由于FSH 抗体的交叉反应引起的。因此,当交叉反应的测量结果高于我们期待的结果时,可以选择另一来源的交叉反应对照物重新测试,以排除由于抗原不纯而引起的对该试剂盒抗体交叉反应的误解。
1.2.4 交叉反应物对测定结果的影响:多大的交叉反应是可能接受的,主要取决于被测物和交叉反应物在人体内的相对含量。如3,5,3’ -三碘甲腺原氨酸 (Triindonhyroxine,T3)和甲状腺素(Thyroxine,T4),因为血清中T4 的含量是T3 的近千倍,所以对于测量T4的试剂盒而言,与T3 存在10%以下的交叉反应率都不会影响T4 的测定,而如果对于测量T3 的试剂盒而言,即使与T4 存在1%的交叉反应率,都会严重影响T3的测定。
1.2.5 其它影响因素:评价试剂盒时还应注意其它因素,如:溶血、高血脂、抗凝剂、其它药物、异嗜性抗体及自身免疫性疾病患者等对样本测定结果的影响,这种影响对不同方法、不同检测项目的影响程度是不一样的,应逐一充分认识。此部分内容可放入抗干扰能力。
1.3 剂量-反应曲线建立
定量标记免疫分析的最主要特征就是建立剂量-反应曲线,通过已知浓度的校准物质(自变量,X)和相应的反应量(因变量,Y)建立剂量-反应关系,并同时测量待测品,通过待测样品的反应量(Y'),计算出未知样品的浓度(X'),因此,这种剂量-反应关系
需要有良好的相关性,即统计学上的“相关系数(r)”(coefficient correlation),当相关系数越趋近于1 时,表明剂量-反应关系越密切。建立剂量-反应曲线时应注意:
1.3.1 选择适当的数学模型拟合
如前所述,在评价试剂盒时,我们通常用双对数(适用于非竞争性双位点夹心法标记免疫分析)数学模型和log-logit(适用于竞争法标记免疫分析)数学模型。一般认为,经适当的函数转换后的标记免疫分析的剂量-反应相关系数或其绝对值(r 或|r|)应不低于0.9900。
1.3.1.1 双对数数学模型:顾名思义,双对数数学模型因函数自变量(剂量)和因变量(反应量)都经对数转换而得名。自然对数和常用对数对剂量-反应曲线的影响仅仅在于截距(A)的不同,通常我们取自然对数:lnY=A+B*lnX。大量的经验表明:多数夹心法标记免疫分析(特别是微量或超微量分析,小于10-9克)经双对数函数转换后,相关系数都能大于0.9900;对于微克级的被测物,选择半对数函数有时能得到更好的相关系数。
1.3.1.2 log-logit 数学模型:经验表明,对于抑制法标记免疫分析,log-logit 数学模型因其计算方法相对简单,且大多数情况下可以得到较好的相关性,因此是评价这类试剂盒的首选数学模型。方程式:
logit Y=A+ B*log X,式中:logit Y=B/B0 /( 1-B/B0)
对于这类试剂盒,还应要求有效剂量值(ED25、ED50、ED75 或ED20、ED50、ED80)应在剂量-反应曲线最高浓度点和最低浓度点之间,即25%(或20%)结合率(B/B0%)所对应的剂量浓度点应小于曲线最高剂量点,75%或(80%)结合率(B/B0%)所对应的剂量浓度点应大于曲线最低剂量点,使曲线在规定的剂量范围内有足够的落差。
1.3.2 标记免疫分析在选择了特异抗体对特异抗原的特定识别以后,剂量-反应曲线在适当浓度的抗原、抗体配伍下,在一定范围内,应呈现良好的相关性,相关系数或其绝对值(r 或|r|)应不低于0.9900。否则应从如下几个方面考虑:
①抗体的浓度是否与抗原浓度相适应;
②选择的剂量范围是否合适;
③选择的函数方程是否合适。
1.4 精密度评价
精密度是考察试剂盒对同一样本重复测定时能否得到相同实验结果的能力的指标,通常用重复多次样本测量结果的变异系数(CV%)表示,精密度评价是质量控制的重要内容。
1.4.1 分析内(intra assay)精密度:同一次实验内(同一块微孔板上或实验条件完全相同的情况下)同一样本(如:质控血清)重复测定(n≥10),测定结果的变异系数(CV%)应不高于10.0%。分析内精密度的变化或异常升高,应从方法学改进、实验室条件改变、操作失当等方面排查原因。
1.4.2 分析间(inter assay)精密度:分析间精密度涵盖
的内容非常广泛,至少应包含入下内容:
同一试剂盒,不同批次之间;
同一试剂盒,同一批次,不同实验室之间;
同一试剂盒,同一批次,同一实验室,不同操作者之间;
同一试剂盒,同一批次,同一操作者,有效期内不同时间之间等。
不同层次的分析间精密度的意义不尽相同,在评价试剂盒质量时应引起质量控制工作者的足够认识。评价分析间精密度时,同一样本(如:质控血清)在上述条件下重复测定(一般n≥10),测定结果的变异系数(CV%)应不高于15.0%。
1.5 准确性评价
准确性评价通常指测量结果趋近于真值的程度。但是,正如我们所认识到的,对于标记免疫分析,特别是具有多种同形异构体的大分子物质而言,目前的分析方法还很难得到真值,因此,还没有真正意义上的“准确性评价”方法,目前通常是通过标准品核对实验或回收率实验进行考察。
1.5.1 标准品核对实验:试剂盒内校准品与相应浓度的国际或国家标准品同时进行分析测定,要求两条剂量-反应曲线不显著偏离平行(t 测验),以国际或国家标准品为对照品,试剂盒内校准品的实测效价与标示效价之比应在0.900~1.100 之间。标准品核对实验应注意:
①配制国际或国家标准品的稀释液应与试剂盒校准物质稀释液相同,以保证两条剂量-反应曲线在相同反应体系下反应;
②配制国际或国家标准品的浓度范围应与试剂盒校准物质实际浓度范围相当,以保证反应能在试剂盒工作范围内进行。
1.5.2 回收率实验
1.5.2.1 添加回收率:选择经纯化、分析过的,性能稳定的已知高浓度的抗原定量加入低浓度被测样本中,并进行分析测定,测定结果与已知理论浓度相比较,应在90.0%~110.0%范围内。
1.5.2.2 稀释回收率:同样选择经纯化、分析过的,性能稳定的已知高浓度的抗原,按照一定比例稀释成系列溶液,并与试剂盒剂量-反应曲线同时测定,高浓度抗原系列与剂量-反应曲线相比较,应不显著偏离平行(t 测验),效价比应在0.900~1.100之间。
添加抗原溶液和稀释液同样应与试剂盒校准物质稀释液相同,以保证反应在相同体系下进行。
注意:至少配制3 个不同浓度添加到空白中的测试物,每一浓度配制2 份样品,每1 次试验对6 份样品重复测定3 次,比较测定值和真实值求出回收率(%),即偏差。
1.6 检测范围(range)
剂量-反应曲线的工作范围(working range)是指能达到一定精密度、准确性和直线性时,测定方法适用的高低限度或量的区间,应使其最精密的部分即曲线斜率最大的部分适合于临床测定需要的范围。它既可以包括全部正常范围(适合于高于和低于这个数值均有诊断意义的物质,如血清胰岛素、地高辛测定),也可以在正常范围的一端(即低于或者高于这个
数值,不是两者均有诊断意义的物质,前者如血清雄烯二酮测定,后者如血清肿瘤标志物分析)。
1.7 高剂量钩变效应(HOOK效应)
当标本中被测物浓度超过线性范围上界时,所得结果反而降低或呈阴性,这种现象被形象地称为高剂量钩变效应(HD-hook effect)。由Miles 等于1974 年用双位点IRMA 测血清铁蛋白时发现。产生这种现象的原因可以归纳为:在一步法试剂盒中是由于大量过剩抗原与被捕获抗原竞争结合限量的标记二抗,二步法试剂盒与抗原的“质”(表位数量及其重复表达数量)有关。固相捕捉抗体过量或有重复表达表位的抗原,呈饱和结合,标记二抗与抗原交叉重叠结合,产生立体效应,使抗原“异构”,与一抗的亲和力减弱。洗涤时,标记二抗体与抗原形成的复合物自固相脱离。用高亲和力的单克隆抗体制备此类试剂可削弱钩变效应的发生。使用时,可以将这些样本进行稀释,使其测量结果落在剂量-反应曲线内,这一测量结果与稀释倍数的乘积即为该样本的原始浓度。
1.8 稳定性评价
试剂盒在有效期内,在规定的条件下保存应保持稳定,各项性能指标应符合质量标准要求。稳定性的实验室检验,可以通过加速降解实验进行,通常的做法是:有效期半年的试剂盒37 ℃放置3 天,有效期1年的试剂盒37 ℃放置7 天后检验,该项性能指标均应符合产品质量标准规定。
目前国家食品监督管理局要求注册提供的稳定性资料包括至少三批样品在实际储存条件下保存至成品有效期后的稳定性研究资料。同时,稳定性资料还应包括模拟运输情况以及开瓶稳定性研究结果等。
1.9 健全性
健全性(validity)是免疫分析可靠性指标之一。免疫化学分析原则上要求校准试剂与被测物质的免疫化学性质相同,即使两者之间的结构有些差异,而它们的剂量-反应曲线不互相偏离平行。一般采用含被测物质的高值血清,按一定的比例稀释,然后测定其含量。如果稀释倍数与含量呈线性关系,那么这个分析具有良好的健全性。也可以在线性回归之后,对校准试剂(试剂盒标准品)剂量-反应曲线的斜率(b1)与高值血清稀释曲线的斜率(b2)的差别作显著性测验,以判断这两条曲线是否显著偏离平行。健全性好坏可以证明未知杂质或被测样品中是否存在交叉反应物质。应使用分析体系中的“零”制剂或分析缓冲液作为稀释剂(diluents)来稀释高值血清样品,以保证稀释样品在理化状态上与其它样品的一致性。
应该注意的是:稀释曲线应做几次重复实验,以排除偶然因素的影响;稀释曲线有时与剂量相关,尤其在偏离平行时要慎重地下结论。
2 定性标记免疫分析方法分析性能评估的主要指标
2.1 阴性参考品符合率
2.1.1 建立阴性参考品:阴性参考品1 套,一般应不少于10 种不同来源的,相对于该项测定是阴性的样本,应包含下述情况:
①正常人样本,应考虑到不同年龄组、不同种群的变化;
②定量标记免疫分析中特异性检验中的结构类似物。
2.1.2 阴性参考品符合率:评价试剂盒的阴性参考品符合率的理想情况应为100%,即全部检测呈阴性。若出现阳性或弱阳性,应视具体情况具体分析。
2.2 阳性参考品符合率
2.2.1 建立阳性参考品:阳性参考品1 套,至少应包含5 种不同来源的,各自有独特代表性的阳性样本,如强阳性样本、弱阳性样本,特别应注意可能引起 “HOOK”效应的高浓度样本。
2.2.2 阳性参考品符合率:同样,评价试剂盒的阳性参考品符合率的理想情况应为100%,即全部检测呈阳性。若出现阴性,应视具体情况具体分析。
2.3 重现性/精密性
定性标记免疫分析试剂对于同一样本重复测定(n≥10),应取得一致的结果。即阴性样本均应呈阴性,阳性样本均应呈阳性。对于反应结果被量化的定性试剂盒,阳性样本反应量的变异系数(CV%)应不高于10.0%。
2.4 cut off 值在筛查性试剂盒与诊断性试剂盒中的意义
定性标记分析试剂盒的所有分析结果都基于cutoff 判定。因此,确定cut off 值对于定性标记免疫分析试剂盒至关重要。建立cut off 值时应选择的个体应考虑排除对被研究指标有影响的因素,且样本量应有统计学意义。习惯上以所选总样本的80%、90%、95%(最常用)、99%的频数为截断点(cut off point),相应的剂量即为cut off 值。
筛查性试剂盒的试验目的是从无症状的人群中找出可能患有某种疾病的患者,是要减少假阴性,就应放宽百分位,通常选择80%或90%的频数为截断点。而诊断性试剂盒是通过实验室检验协助医生确定患者是否患有某种疾病,要减少假阳性,就要适当放宽假阴性,取95%或99%的频数为截断点。因此,同一试剂盒用于筛查性目的时和用于检验性目的时的cut off 值可能不同。具体可参照我整理的另一文章“关于截断值的确认”。
2.5 稳定性
同定量试剂要求。
3 质控血清的制备、标定和应用
3.1 制备
理想的质控样本至少应包含下列特征:与被测物来源相同,有一定批量,规定条件下保存性质稳定,冻干品分装支间差异小,无传染性等。如,甲状腺功能检测的质控样本,可以分别收集甲亢、甲低和正常人血清,混合后制备的质控血清应涵盖被测物剂量-反应曲线的低、中、高三个区域。但实际操作时由于要求质控样本有一定的批量,可以供一段时间内连续使用,并应对血源进行生物安全性检测,因此,收集临床样本制备质控血清被认为不太现实。目前通常采用的是在正常人血清中定量添加被测物的方法制备质控血清。具体方法是:
①收集一定量的被测物人血清,或制备不含被测物血清,经生物安全性检验呈阴性,离心、过滤、去杂质,加防腐剂;
②加入被测物高纯品,分别在曲线低、中、高三个区域配制成三种浓度质控血清;
③分装、冷干,得到质控血清成品,-20 ℃保存,备用。
3.2 标定和应用
选择一定的分析系统,对质控血清进行重复测定(n≥20),计算均值和标准差,一般以均值为质控血清的靶值,均值±2倍标准差为质控血清的测定上限和下限。
实验室在进行分析检测时应自觉使用质控血清开展内部质量控制工作。按照规定,每次实验中质控血清数量应为实验总量的平方根。如,一块96孔板的实验中应安排质控血清数量9~10孔。每个点均应为双复孔,且安排在微孔板的上、下、左、中、右不同位置。
3.3 记录质控结果和绘制质控图
确定质控血清的靶值是绘制质控图的基础,分别绘制低、中、高三个质控血清的质控图。以实验次数为横轴,以每次实验质控血清测定值为纵轴,绘制质控图(见图3)。建立质控图后,每次实验的质控血清测定值都应记录在质控图上。
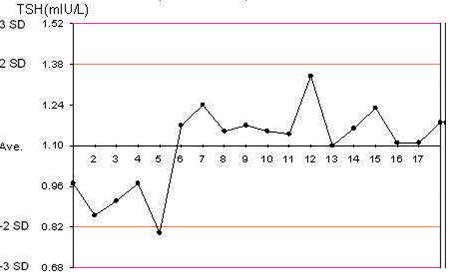
图1 质控图
Figure 1 Quality control chart
3.4 对质控图记录结果的评价与分析
理想的检测结果均应在靶值附近,明显偏离靶值或重复偏向靶值同侧的结果均应引起足够重视。质控血清测定值的异常是实验过程中出现异常变异的最直接的综合反映,应根据前面讲述的质量控制基本内容逐一排查原因。值得注意的是,目前应用的内部质量控制的方法仅仅能评价实验室测量结果的可重复性(精密度),而不是它的“准确性”。
总之,一个单位在研制生产一种新的体外诊断试剂盒产品时,都要对该产品的适用性和可靠性等性能进行测定和评价,需要对下述问题进行全方位考虑:
①该试剂盒是否达到了特定的要求?
②该试剂盒的灵敏性、重复性、准确性和精密性方面是否达到了要求?
③该试剂盒在技术上是否要求很苛刻?
④临床使用时是否需具有应用该试剂盒的专业知识?是否需要培训?
⑤该试剂盒是否需要特殊的设备?
⑥该试剂盒是否造价很高?
⑦该试剂盒是否需要时间过长?
本文对试剂盒分析性能的评估做了详细介绍,提请研发人员主要应对上述指标进行测定考核,以确定该产品在本研究内能够得到准确和重复的实验结果,并且在测定范围、测定限度和特异性等方面达到了测定的要求,确保实验数据的准确与可靠。在实验设计时,一定要注意重复性问题,尤其在标准确认过程中,多复孔设计及多次重复实验是必须的。
(选自《分子诊断与治疗杂志》2010 年3 月第2 卷第2 期J Mol Diagn Ther, March 2010, Vol. 2 No. 2,如侵犯版权,请版权人发邮件到webmaster@dmlab.com.cn通知,我们将立即致歉并删除)
|

